
1. Giới thiệu
Tài liệu là một phần thiết yếu của hệ thống đảm bảo chất lượng và nhằm chứng minh các hoạt động liên quan đến GMP được thực hiện một cách thích hợp và kịp thời. Tất cả các thông tin liên quan được ghi lại rõ ràng và đầy đủ để giảm thiểu các lỗi trong diễn giải hoặc giao tiếp bằng miệng. Tài liệu phản ánh việc lên kế hoạch, kiểm soát và đánh giá chất lượng của thuốc. Ngoài ra, nó phải phù hợp với các yêu cầu được mô tả trong Chương 4 “Tài liệu” của hướng dẫn EU-GMP.
2. Tài liệu, hồ sơ GMP
Theo hướng dẫn của EU-GMP, hệ thống tài liệu GMP bao gồm các tài liệu sau:
- Hồ sơ gốc của nhà máy: Tài liệu mô tả các hoạt động liên quan đến GMP của nhà sản xuất,
- Tài liệu hướng dẫn:
- Tiêu chuẩn kỹ thuật: Các yêu cầu chi tiết mà sản phẩm hoặc nguyên liệu phải đáp ứng trong quá trình sản xuất,
- Công thức sản xuất, Hướng dẫn pha chế, Hướng dẫn đóng gói, Hướng dẫn thử nghiệm,
- Quy trình (Quy trình thao tác chuẩn – SOP),
- Đề cương,
- Thỏa thuận kỹ thuật: Được sử dụng trong các hoạt động với các đối tác bên ngoài.
- Hồ sơ/báo cáo:
- Hồ sơ: Cung cấp bằng chứng để chứng minh sự tuân thủ theo các yêu cầu của tài liệu hướng dẫn,
- Chứng nhận phân tích,
- Báo cáo.
Ví dụ về cấu trúc hệ thống tài liệu được mô tả trong Hình 1.

Tài liệu GMP thường bao gồm một cặp tài liệu: tài liệu hướng dẫn và hồ sơ/ báo cáo xác nhận rằng các hoạt động trong thực tế đã thực hiện tuân theo tài liệu hướng dẫn. Có một số khác biệt giữa hai tài liệu này như sau (Bảng 1):
Bảng 1: Tài liệu và hồ sơ GMP
| Tài liệu hướng dẫn | Hồ sơ hoặc Báo cáo |
| Mô tả các yêu cầu, quy định | Ghi lại các hoạt động trên thực tế hoặc kết quả của các hoạt động này, Trình bày các nội dung quan trọng của tài liệu hướng dẫn theo cách dễ theo dõi để thực hiện |
| Được xây dựng, xem xét và phê duyệt trước | Được ghi lại ngay sau khi hoạt động liên quan diễn ra |
| Thường không có các mục viết tay | Các mục viết tay có thể được thực hiện (tuân thủ theo quy định trong Thực hành tốt ghi chép hồ sơ, tài liệu) |
| Ví dụ: Tiêu chuẩn kỹ thuật, quy trình hướng dẫn, hợp đồng … | Ví dụ: Hồ sơ lô sản xuất, báo cáo kiểm tra… |
3. Kiểm soát hệ thống tài liệu
Mặc dù hệ thống tài liệu có sự khác biệt đáng kể về loại và phạm vi, nhưng các quy định chính thức sau đây được áp dụng trong quá trình biên soạn tài liệu:
- Phạm vi áp dụng và mục đích của tài liệu: Mô tả bộ phận/khu vực tài liệu được áp dụng và mục đích của tài liệu. Nếu một trong những nội dung này không được quy định rõ ràng, tài liệu có thể bị hiểu sai,
- Dạng văn bản: “Bất cứ sự việc nào không được ghi lại thì xem như không xảy ra”. Nguyên tắc này thể hiện trong các yêu cầu của tài liệu hướng dẫn và ghi lại các hoạt động đã hoàn thành trong hồ sơ, báo cáo. Các mục viết tay phải rõ ràng, dễ đọc và không thể tẩy xóa (bút chì không được sử dụng),
- Tính đúng đắn: Nội dung của tài liệu phải tuân thủ các quy định trong hồ sơ nộp cho cơ quan quản lý (Marketing Authorization) hoặc các tài liệu cấp cao khác, cũng như tình hình thực tế trong công ty. Độ chính xác của dữ liệu quan trọng được kiểm tra bằng cách sử dụng nguyên tắc kiểm soát kép, tức là, được kiểm tra bởi người thứ hai,
- Tính đầy đủ: Tất cả các hồ sơ, báo cáo phải được hoàn thành mà không có khoảng trống hay mục chưa điền. Các nội dung trống được ghi chú bằng “Không áp dụng” hoặc “N/A”, kèm theo ngày và chữ ký. Tổng số trang hoặc bảng nội dung có thể được sử dụng để đảm bảo tính đầy đủ của tài liệu,
- Tính chính xác: Nội dung tài liệu phải đủ chính xác để đảm bảo việc sử dụng đúng như mong muốn. Do đó, cần tránh những từ ngữ chung chung, không cụ thể (xem ví dụ trong Bảng 2).
- Tính cập nhật: Tất cả các tài liệu và hồ sơ phải được cập nhật thường xuyên và đầy đủ. Khi có bất kỳ thay đổi nào, các tài liệu phải được biên soạn theo đúng thời hạn đã đặt ra. Đối với sổ nhật ký và các hồ sơ khác, chúng sẽ được cập nhật tại thời điểm các hoạt động liên quan diễn ra.
- Tính sẵn có: Các tài liệu liên quan phải có sẵn cho người sử dụng tại vị trí đã quy định. Khi tài liệu có sự thay đổi, họ phải được thông báo kịp thời.
- Phê duyệt: Tài liệu và hồ sơ phải được người có thẩm quyền phê duyệt. Một điều kiện tiên quyết để phê duyệt một tài liệu là sự phù hợp của nó (tính chính xác, mang tính thời sự, tính thực tiễn).
- Một tài liệu được xem là dễ hiểu nếu người đọc có thể hiểu nội dung của tài liệu với kiến thức sẵn có của họ:
- Một tài liệu hướng dẫn cho nhân viên tạm thời, kém kỹ năng cần phải được xây dựng khác với tài liệu cho nhân viên chuyên môn đã được đào tạo,
- Đối với các tài liệu cấp cao hơn, (ví dụ: hướng dẫn quản lý chất lượng), chỉ đơn giản là đưa ra mục tiêu tài liệu và để ngỏ các phương tiện cần có để đạt được những mục tiêu đặt ra,
- Ở cấp độ vận hành, (ví dụ: hướng dẫn sản xuất), các yêu cầu kỹ thuật chi tiết để đạt được mục tiêu là cần thiết và mục tiêu kiểm soát phải được trình bày. Do đó, những hướng dẫn này phải chính xác và rõ ràng.
Bảng 2: Ví dụ về tính chính xác
| Sai | Đúng |
| “đủ lâu” | x đến y phút/giờ |
| “nếu có thể” | Mô tả rõ ràng, Xác định trường hợp ngoại lệ |
| “nếu có”, “nếu cần” | Xác định rõ trường hợp áp dụng |
| “nên”, “nên là”, “có thể” | “phải là” |
| … | … |
4. Định dạng và cấu trúc tài liệu
Định dạng và cấu trúc của tài liệu phải thống nhất. Điều này sẽ làm tăng khả năng đọc hiểu và làm cho tài liệu dễ nhận biết hơn, vì vậy sẽ giúp tăng mức độ chấp nhận tài liệu:
- Định dạng tài liệu: ví dụ về định dạng bao gồm loại font chữ và kích thước, khoảng cách dòng, định dạng đoạn văn, bố trí tiêu đề tài liệu và chân trang, viền hoặc tiêu đề …
- Một cấu trúc tài liệu mang tính logic sẽ cung cấp một cái nhìn tổng quan, tăng khả năng phát hiện nội dung trong văn bản, đồng thời giúp các thay đổi thực hiện dễ dàng hơn. Do đó làm giảm thời gian cần xử lý tài liệu. Ví dụ về cấu trúc của một tài liệu được thể hiện trong Hình 2.

5. Vòng đời của tài liệu
Tương tự như cơ sở vật chất hoặc thiết bị, tài liệu cũng trải qua một số giai đoạn điển hình trong vòng đời của chúng (Hình 3). Các tài liệu phải được xử lý thích hợp với các yêu cầu đã được thiết lập ở từng giai đoạn để đảm bảo rằng chúng phù hợp với mục đích sử dụng ban đầu.
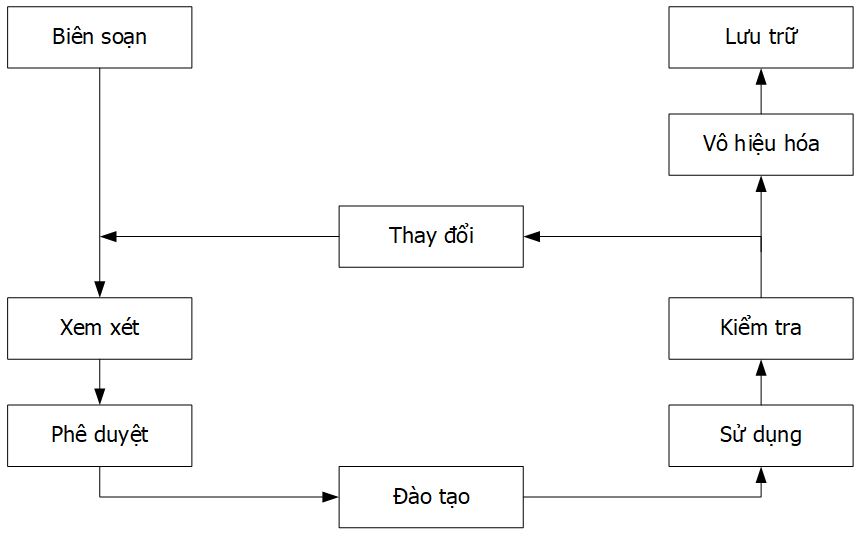
Biên soạn và thay đổi
Các tài liệu mới chỉ được biên soạn và các tài liệu hiện có chỉ được thay đổi bởi người có kinh nghiệm trong thực tế.
Thay đổi đối với tài liệu chỉ có thể được thực hiện sau khi chúng đã được phê duyệt. Những thay đổi này cần được mô tả trong lịch sử tài liệu.
Xem xét
Hình thức và nội dung của tài liệu được xem xét bởi người có trách nhiệm, ví dụ:
- Định dạng và cấu trúc của tài liệu: nhân viên thuộc bộ phận Đảm bảo chất lượng,
- Nội dung: một người có kiến thức và kinh nghiệm phù hợp để đánh giá các quy định do người biên soạn đặt ra.
Phê duyệt
Một người chịu trách nhiệm của khu vực được quy định bởi tài liệu, ví dụ: Trưởng phòng sản xuất hoặc trưởng phòng QC.
Đào tạo
Các nhân viên có liên quan phải biết, hiểu và có thể áp dụng các tài liệu. Sau đó, anh ấy/cô ấy xác nhận đã được đào tạo bằng chữ ký trong biểu mẫu đào tạo.
Sử dụng
Tài liệu phải có sẵn tại vị trí đã quy định trong suốt thời gian có hiệu lực của nó. Cần xác định khi nào các bản sao tài liệu có thể được thực hiện và chuyển cho bên thứ ba (nếu cần thiết). Hướng dẫn quy định quá trình này phải được thiết lập.
Sự kiểm tra
Xác định xem các tài liệu có được tuân thủ hay không và liệu nội dung của chúng có còn cập nhật và phù hợp hay không.
Vô hiệu hóa
Thời gian có hiệu lực của tài liệu nên được thiết lập. Thời hạn ba năm có thể xem như giới hạn thường sử dụng. Tài liệu sẽ không được sử dụng sau khoảng thời gian đó, ngoại trừ khi nó đã được xem xét chính thức và phiên bản mới đã được ban hành. Các tài liệu không còn hiệu lực sẽ không được sử dụng. Tài liệu hết hạn phải được thu hồi.
Lưu trữ
Mỗi quốc gia sẽ quy định về thời hạn lưu trữ tài liệu nhất định. Tài liệu phải được lưu giữ trong khu vực thích hợp. Chỉ có những người có thẩm quyền mới được truy cập vào tài liệu đã được lưu trữ.
Xử lý bản sao của tài liệu
Một số lượng nhất định các bản sao tài liệu được tạo và phân phối. Các quy tắc bằng văn bản phải quy định rõ ràng về:
- Người có thẩm quyền trong việc tạo bản sao tài liệu,
- Số lượng bản sao được tạo,
- Ai có thể nhận được bản sao tài liệu (khách hàng, cơ quan chức năng),
- Làm thế nào để nhận diện bản sao hợp lệ và,
- Làm thế nào để trả lại hoặc phá hủy bản sao không hợp lệ.
6. Tài liệu tham khảo
- EU-GMP guideline, Part I, Chapter 4 “Documentation”,
- GMP – WHO TRS 986, Annex 2: WHO-GMP for pharmaceutical product, main principles, section 15 “Documentation”,
- GMP – Verlag, Chapter 15 “Documentation”.





You must be logged in to post a comment.