
Từ năm 2008, Việt Nam được xếp vào nhóm các nước có ngành dược mới nổi – Pharmerging theo phân loại của tổ chức IMS Health (hiện nay là tổ chức IQVIA). Chi tiêu bình quân đầu người cho tiền thuốc tại nước ta vẫn còn tương đối thấp nhưng đã có sự ghi nhận gia tăng mạnh mẽ trong thời gian qua. Năm 2005 khoảng 9,85 USD/người (tương đương khoảng gần 227.000 VND/người), 34,48 USD/người (tương đương khoảng 793.000 VND/người) vào năm 2014, dự báo đến năm 2025 tăng lên 163 USD/người (tương đương khoảng 3.749.000 VND/người). Cùng với đó, dân số đông và sự già hóa nhanh chóng tại Việt Nam (tỷ lệ người cao tuổi trong giai đoạn 1979 – 2015 chiếm 6,9% lên 11,3% và dự báo đến năm 2049 sẽ chiếm 25% trên tổng dân số) đã thúc đẩy nhu cầu chăm sóc sức khỏe của người dân tăng cao và đặc biệt là nhu cầu về sử dụng dược phẩm.
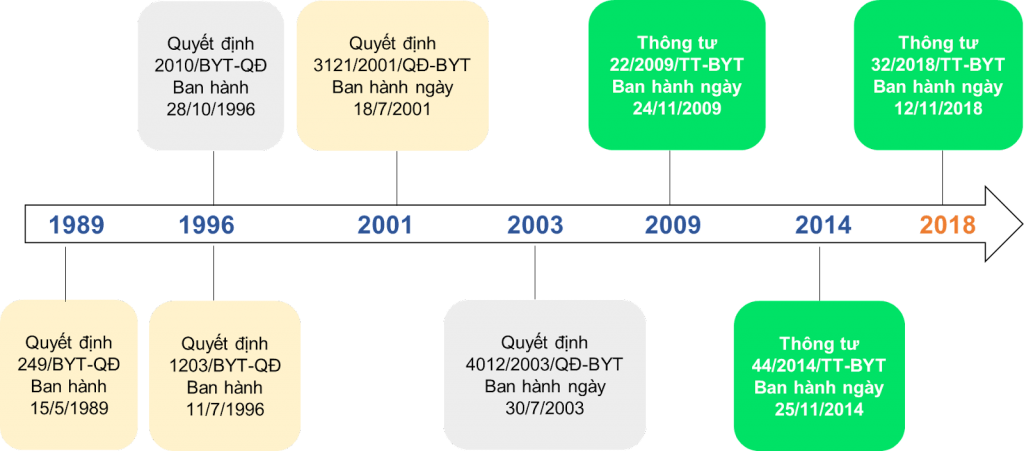
Thuốc là một loại hàng hóa đặc biệt, có ảnh hưởng trực tiếp đến sức khỏe của người sử dụng. Do đó thuốc muốn được lưu hành trên thị trường, phân phối đến tay người dùng phải được Bộ Y tế (BYT) cụ thể là Cục Quản lý Dược (QLD) cấp số đăng ký (SĐK) lưu hành. Việc đăng ký thuốc là hàng rào pháp lý bắt buộc nhằm giảm thiểu tối đa sự xuất hiện của thuốc giả, thuốc kém chất lượng trên thị trường. Trong “Chiến lược quốc gia phát triển ngành dược Việt Nam giai đoạn đến năm 2020 và tầm nhìn đến năm 2030” của Thủ tướng Chính phủ cũng thể hiện quan điểm phát triển là cung ứng đủ thuốc cho nhu cầu phòng bệnh, chữa bệnh của nhân dân với chất lượng đảm bảo, giá hợp lý trong đó chú trọng việc phát triển thuốc sản xuất trong nước, đặc biệt là các thuốc thiết yếu, thuốc đông y, thuốc dược liệu., Quy định về đăng ký thuốc tại Việt Nam đã trải qua 31 năm kể từ khi quyết định số 249/BYT-QĐ đầu tiên được ban hành vào 15/5/1989. Theo đó quy định đã có nhiều sự thay đổi nhằm hoàn thiện hơn về quy định đăng ký thuốc tại Việt Nam. Thông tư 22/2009/TT-BYT đã đánh dấu sự thay đổi lớn trong quy định đăng ký thuốc khi hợp nhất việc đăng ký thuốc hóa dược, thuốc từ dược liệu, cổ truyền và vắc xin và sinh phẩm y tế trong một thông tư. Các quyết định, thông tư quy định trong việc đăng ký thuốc đã được ban hành tại Việt Nam từ năm 1989 đến hiện nay được thể hiện qua sơ đồ dưới đây.
Trong giai đoạn 11 năm, từ năm 2009-2019, Việt Nam tổng cộng có 45.628 SĐK được cấp cho thuốc.
Trong đó có 2 cột mốc là năm 2010 (năm có hiệu lực của thông tư 22/2009/TT-BYT) và năm 2015 (năm có hiệu lực của thông tư 44/2014/TT-BYT).
Kể từ năm 2010 trở đi số lượng SĐK có xu hướng giảm mạnh, trong đó số lượng năm 2011 giảm 1.890 số (tương đương giảm 26,5% so với năm 2010) và năm 2012 chỉ còn 3.873 số đã giảm đi khoảng 45% so với năm 2010.
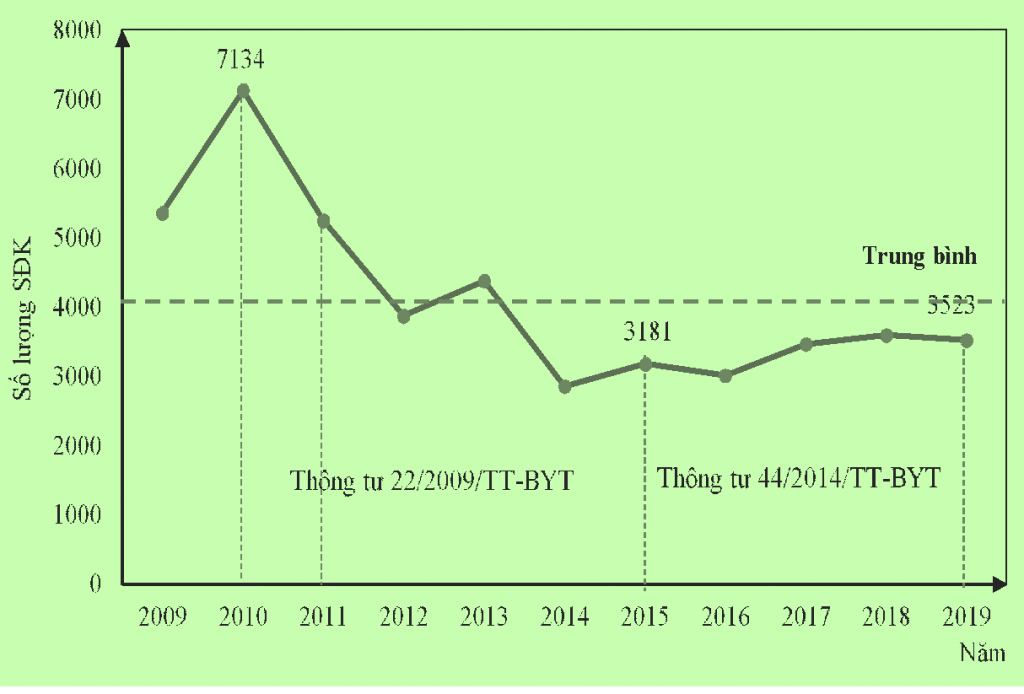
Sự ra đời của thông tư 22/2009/TT-BYT có thể đã tác động mạnh mẽ đến việc đăng ký thuốc ở nước ta, đây là thông tư đầu tiên quy định chung việc đăng ký thuốc hóa dược, thuốc cổ truyền, thuốc từ dược liệu với quy định đăng ký vắc xin và sinh phẩm trong cùng một thông tư. Cùng với đó là sự thay đổi trong quy định về hồ sơ đăng ký thuốc của thông tư 22 so với quyết định 3121/2001/QĐ-BYT trước đó khi chuyển từ việc phân loại hồ sơ đăng ký thuốc theo nguồn gốc sản xuất sang phân loại theo loại thuốc. Quy định về đăng ký thuốc được kiểm soát chặt chẽ hơn trong thông tư 22 và là cột mốc đầu tiên đánh dấu việc áp dụng Hồ sơ kỹ thuật chung ASEAN (ACTD) trong hồ sơ đăng ký thuốc.
Về nguồn gốc thuốc, số lượng SĐK thuốc trong nước được cấp là 28.219 số, chiếm 61,8% trên tổng SĐK thuốc được cấp tại nước ta, đối với thuốc nước ngoài trung bình 11 năm chiếm 38,2% với 17.409 số.
Trong những năm gần đây thuốc nước ngoài có xu hướng giảm cả về số lượng SĐK và tỷ lệ phần trăm, cụ thể kể từ năm 2016 – 2019 số lượng SĐK của thuốc nước ngoài dao động trong khoảng 813 – 1012 số (chiếm dưới 50% so với số lượng được cấp giai đoạn 2009 – 2011) và tỷ lệ phần trăm của thuốc nước ngoài luôn chiếm dưới 30% trên tổng SĐK được cấp tại nước ta.
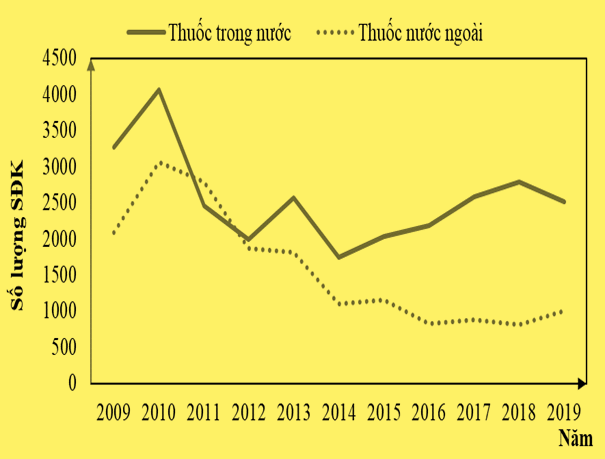
Sự gia tăng tỷ lệ phần trăm của các thuốc trong nước so với thuốc nước ngoài có thể xuất phát từ các chính sách hỗ trợ, ưu tiên, khuyến khích của Cơ quan quản lý nhà nước đối với các doanh nghiệp Dược trong nước trong việc gia tăng sản xuất, nghiên cứu, đăng ký thuốc cũng như ưu tiên trong việc đấu thầu mua sắm thuốc nhằm đáp ứng nhu cầu trị bệnh của người dân. Điều này được thể hiện cụ thể trong Luật Dược số 105/2016/QH13 về việc ưu tiên mua thuốc generic, sinh phẩm tương tự đầu tiên sản xuất trong nước được cấp giấy đăng ký lưu hành tại Việt Nam; thuốc dược liệu, thuốc cổ truyền được sản xuất từ nguồn dược liệu trong nước. Ngoài ra, việc ưu tiên sử dụng thuốc do doanh nghiệp trong nước sản xuất còn được thể hiện trong đề án “Người Việt Nam ưu tiên dùng thuốc Việt Nam” do Bộ Y tế phê duyệt trong quyết định số 4824/QĐ-BYT ban hành ngày 03/12/2012. Các chính sách này đã phần nào góp phần trong việc tạo động lực và thúc đẩy các công ty sản xuất thuốc trong nước tăng cường nghiên cứu, phát triển thuốc ngày càng giảm bớt sự phụ thuộc vào các thuốc được nhập khẩu.
Trong năm 2001, nước ta chỉ có khoảng 36 quốc gia có SĐK lưu hành được cấp, thì đến nay đã có hơn 50 quốc gia có thuốc được đăng ký lưu hành mỗi năm (trung bình có 52 quốc gia/năm trong giai đoạn 2009 – 2019 đăng ký).

Sự gia tăng về số lượng quốc gia đăng ký thuốc cho thấy thị trường dược phẩm Việt Nam ngày càng khẳng định là một thị trường đầy tiềm năng, thu hút được nhiều sự quan tâm từ các công ty, doanh nghiệp trên thế giới. Tuy số lượng quốc gia đăng ký đã tăng khoảng 1,3 lần so với năm 2001 nhưng phần lớn các thuốc nước ngoài đăng ký đều có nguồn gốc từ Ấn Độ (chiếm 33,9%) và Hàn Quốc (chiếm 17,3%). Không chỉ riêng giai đoạn 2009 – 2019 mà trong giai đoạn 2000 – 2006 hai quốc gia này cũng là hai quốc gia có nhiều SĐK nhất khi chiếm tỷ lệ lần lượt là 31,5% và 21,2%. Có thể thấy, chỉ riêng hai quốc gia này đã chiếm hơn 50% số lượng SĐK được cấp tại nước ta, trong khi đó một số quốc gia như lại có rất ít SĐK, chỉ vài SĐK cho cả giai đoạn 11 năm điển hình như Croatia (2 SĐK), Litva (2 SĐK); Slovakia (4 SĐK) điều này cho thấy sự mất cân bằng trong cơ cấu các quốc gia đăng ký thuốc tại Việt Nam. Tuy nhiên, trong các năm gần đây số lượng SĐK cũng như tỷ lệ phần trăm trên tổng SĐK được cấp của 10 quốc gia được cấp SĐK nhiều nói chung và Ấn Độ, Hàn Quốc nói riêng thì đang có xu hướng giảm. Cụ thể, Ấn Độ trong 5 năm gần đây từ 2015 – 2019 luôn chiếm dưới 30% và tỷ lệ phần trăm của 10 quốc gia cũng chiếm dưới 70%, có thể thấy đã có sự gia tăng số lượng ở các quốc gia khác làm giảm đi sự chiếm lĩnh thị trường của 10 quốc gia nói trên. Trong số 10 quốc gia đăng ký nhiều cũng phải kể đến Trung Quốc, đây là quốc gia được xem là có sự biến đổi khá lớn với tốc độ tăng tưởng số lượng SĐK khá cao. Giai đoạn 2000 – 2006 Trung Quốc chỉ được xếp thứ 12 trong các quốc gia có nhiều SĐK tại Việt Nam (chiếm 1,81%) nhưng đến giai đoạn 2009 – 2019 Trung Quốc đã chiếm 3,5% và đứng thứ 4 trong 10 quốc gia có nhiều SĐK nhất, cao hơn cả Pháp (với 3,3%) là quốc gia đứng 3 trong giai đoạn 2000 – 2006 chiếm đến 7,0% trên tổng SĐK được cấp tại nước ta.
Về phân loại thuốc theo dạng đơn thành phần, dạng phối hợp, các thuốc hóa dược và sinh phẩm dạng đơn thành phần ở nước ta giai đoạn 2009 – 2019 chiếm khoảng 80,0% với tổng 34.055 SĐK, thuốc dạng phối hợp với 8.502 SĐK (chiếm 20,0%). Trong đó, cơ cấu tỷ lệ thuốc đơn thành phần trong nước thấp hơn so với cơ cấu tỷ lệ của thuốc dạng đơn thành phần nước ngoài (thuốc dạng đơn thành phần trong nước trung bình chiếm 77,8% trên tổng SĐK hóa dược, sinh phẩm được cấp trong nước, tỷ lệ này là 83,3% đối với thuốc nước ngoài). Tỷ lệ thuốc đơn thành phần trong nước đã có sự gia tăng đáng kể trong thời gian qua, trong giai đoạn 2001 – 2005 thuốc đơn thành phần trong nước chỉ chiếm từ 55 – 65% trên tổng SĐK hóa dược, đến giai đoạn 2009 – 2019 tỷ lệ này đã gia tăng đáng kể khi chiếm từ 70,8 – 85,6% (tăng 15,8 – 20,6%). Điều này cho thấy, thuốc trong nước ngày càng phù hợp với các khuyến cáo của WHO cũng như của BYT khi ưu tiên sử dụng các thuốc dạng đơn thành phần. Nếu là thuốc dạng phối hợp phải chứng minh được sự kết hợp đó có lợi hơn khi dùng từng thành phần riêng rẽ về tác dụng và độ an toàn. Đối với thuốc từ dược liệu, thuốc cổ truyền có sự trái ngược với thuốc hóa dược khi chủ yếu là dưới dạng thuốc phối hợp chiếm 80,3% gấp khoảng 4 lần so với thuốc dạng đơn thành phần (chiếm 19,7%). Dạng phối hợp chiếm chủ đạo là điều khá phù hợp khi ở nước ta hầu hết các thuốc cổ truyền, thuốc từ dược liệu chủ yếu được dựa trên các bài thuốc xưa, là sự kết hợp của nhiều loại thuốc với nhau theo lý luận và phương pháp của y học cổ truyền (Quân, thần, tá, sứ) hoặc theo kinh nghiệm dân gian dưới dạng bào chế truyền thống hoặc hiện đại. Đối với vắc xin, loại vắc xin đơn chiếm 74,8% với tổng 110 SĐK, gấp gần 3 lần so với vắc xin loại phối hợp (37 SĐK với 25,2%). Đối với vắc xin phối hợp trong nước trong giai đoạn 2009 – 2019 đã có tổng 8 SĐK được cấp gồm 2 loại vắc xin phối hợp 2 trong 1: Bạch hầu, uốn ván; Sởi, rubella và 1 loại vắc xin phối hợp 3 trong 1: Bạch hầu, ho gà, uốn ván.

Thuốc viên nén là dạng bào chế được đăng ký nhiều nhất ở cả thuốc được sản xuất trong nước và thuốc nước ngoài chiếm khoảng 46,4% trong cả giai đoạn 2009 – 2019. Trong đó, thuốc nang là dạng bào chế thông dụng thứ hai ở nước ta được đăng ký (chiếm 18,6%) nhưng phần lớn đến từ thuốc sản xuất trong nước. Đối với dạng thuốc tiêm, tiêm truyền với 16,9% chủ yếu là các thuốc sản xuất bởi nước ngoài. Paracetamol là hoạt chất được đăng ký nhiều nhất ở nước ta, chủ yếu là thuốc sản xuất trong nước (chiếm 2068/2260 SĐK được đăng ký). Trong đó, các vitamin như vitamin B1, B6, C và các vitamin khác tuy có số lượng SĐK lớn nhưng hầu hết đều nằm trong dạng phối hợp hỗn hợp vitamin và khoáng chất và không nhiều tác dụng dược lý cụ thể. Tuy nhiên kể từ năm 2014 đến 2019 số lượng SĐK được cấp cho vitamin đã có xu hướng giảm thể hiện qua việc phần lớn các vitamin không còn nằm trong danh mục 20 hoạt chất được đăng ký nhiều nhất, đối với các vitamin vẫn còn trong danh mục thì thứ hạng có xu hướng giảm so với các năm trước đó. Đối với những hoạt chất như Paracetamol có quá nhiều SĐK cho 1 hoạt chất dẫn đến việc lãng phí khi có những hoạt chất khác lại có rất ít hoặc không có SĐK nào bên cạnh đó còn dẫn đến sự cạnh tranh gay gắt trên thị trường khi có quá nhiều sản phẩm cho cùng 1 hoạt chất. Cụ thể, Protamin tuy là hoạt chất nằm trong danh mục thuốc thiết yếu của cả WHO và BYT nhưng lại không có SĐK nào được đăng ký ở nước ta, hiện tại hoạt chất này vẫn đang được nhập khẩu không cần SĐK. Các doanh nghiệp dược cần ưu tiên nghiên cứu phát triển, sản xuất các hoạt chất đang có rất ít SĐK, không có SĐK hoặc SĐK đã hết hạn ở nước ta, cụ thể là 508 hoạt chất chưa có SĐK hoặc SĐK đã hết hiệu lực được ban hành trong quyết định số 11599/QLD-ĐK ngày 30/6/2015 của Cục Quản lý Dược để kịp thời đáp ứng nhu cầu sử dụng thuốc của người dân.
Một trong những khó khăn lớn nhất khi nghiên cứu thực hiện đề tài này là hầu hết các thông tin về danh mục các thuốc được cấp số đăng ký đăng tải trên trang thông tin điện tử của Cục QLD (dav.gov.vn) không được đầy đủ. Đối với các thông tin của các thuốc trong danh mục cấp số đăng ký một số vẫn còn thiếu các thông tin như hàm lượng, tên gọi và cách ghi của các hoạt chất chưa được đồng nhất hóa dẫn đến việc khó khăn trong quá trình xử lý dữ liệu. Và việc đồng nhất hóa tên gọi, cách ghi của các hoạt chất trong danh mục cấp số đăng ký hiện tại vẫn chưa được quy định cụ thể trong bất kỳ văn bản quy phạm pháp luật nào ở nước ta. Vì thế, trong tương lai để các nghiên cứu khác về vấn đề này có thể được thực hiện nhiều hơn, Cơ quản lý nhà nước cần đăng tải thường xuyên và cập nhật các danh mục thuốc được cấp SĐK trên trang thông tin điện tử, có các quy định cụ thể về việc đồng nhất tên gọi, cách ghi tên hoạt chất trong các danh mục thuốc được cấp SĐK lưu hành. Tổng quan về tình hình đăng ký thuốc tại Việt Nam từ năm 2009 đến năm 2019 giúp các cơ quan quản lý dược, các doanh nghiệp (trong và ngoài nước) nắm bắt được xu hướng và nhu cầu của thị trường dược Việt Nam. Đây là cơ sở để định hướng phát triển thị trường dược phẩm và đề xuất các chính sách chăm sóc sức khỏe phù hợp.
Bộ Y Tế (1989), “Quyết định số 249/BYT-QĐ ngày 15/5/1989 Ban hành Quy chế đăng ký sản xuất trong nước, đăng ký thuốc nước ngoài vào Việt Nam”.
Bộ Y Tế (1996), “Quyết định số 1203/BYT-QĐ quyết định về việc ban hành Quy chế đăng ký thuốc”.
Bộ Y Tế (2001), “Quyết định số 3121/2001/QĐ-BYT về Quy chế đăng ký thuốc”.
Bộ Y Tế (1996), “Quyết định số 2010/BYT-QĐ ban hành Quy chế đăng ký vắc xin, sinh phẩm miễn dịch”.
Bộ Y Tế (2009), “Thông tư số 22/2009/TT-BYT Quy định việc đăng ký thuốc”.
Bộ Y Tế (2003), “Quyết định số 4012/2003/QĐ-BYT ban hành Quy chế đăng ký vắc xin, sinh phẩm y tế”.
Bộ Y Tế (2004), “Quyết định số 3947/2004/QĐ-BYT về việc sửa đổi, bổ sung Quy chế đăng ký vắc xin, sinh phẩm y tế”.
Bộ Y Tế (2009), “Thông tư số 22/2009/TT-BYT Quy định việc đăng ký thuốc”.
Bộ Y Tế (2014), “Thông tư số 44/2014/TT-BYT Quy định việc đăng ký thuốc”.
Cục Quản lý Dược – Bộ Y tế “Những điểm mới trong đăng ký thuốc thông tư 44/2014/TT-BYT “.
Bộ Y Tế (2018), “Thông tư số 32/2018/TT-BYT Quy định việc đăng ký lưu hành thuốc, nguyên liệu làm thuốc”.
Bùi Thúy Vân (2006), Bước đầu phân tích đánh giá nhóm thuốc nước ngoài được đảng ký lưu hành ở Việt Nam, Bộ môn Quản lý và Kinh tế Dược, Đại học Dược Hà Nội.
Bộ Y Tế (2018), “Thông tư số 19/2018/TT-BYT Ban hành danh mục thuốc thiết yếu”.
Nguồn: Bài viết dựa trên công bố từ công trình của nhóm tác giả: Nguyễn Thị Hải Yến, Thái Huế Ngân và cộng sự tại ĐH Y Dược TPHCM. Các dữ liệu được trích dẫn với sự đồng ý của nhóm tác giả. (https://js.vnu.edu.vn/MPS/article/view/4297)





You must be logged in to post a comment.