
Nghiên cứu – phát triển nhiều loại thuốc mới giúp mở ra cơ hội điều trị, thay đổi cuộc sống cho hàng triệu bệnh nhân. Tuy nhiên, phát triển và sản xuất thuốc mới là một quá trình rất nhiều khó khăn, cần nhiều thời gian nghiên cứu, trang thiết bị, nguồn lực và chi phí khổng lồ.
1. Con đường hơn một thập kỷ cho một thuốc mới ra đời
Mỗi năm trên thế giới có vài chục loại thuốc mới được cấp phép đưa vào sử dụng, nhưng trước đó đã có hàng chục nghìn loại hợp chất ứng cử viên đã bị loại bỏ. Tìm kiếm, phát triển và sản xuất thuốc mới là một quá trình mất rất nhiều thời gian và phức tạp. Trung bình, quá trình này từ khi nghiên cứu, phát triển đến khi thuốc được đưa ra thị trường sẽ mất khoảng 10-15 năm và tiêu tốn hơn 1 tỷ đô la.
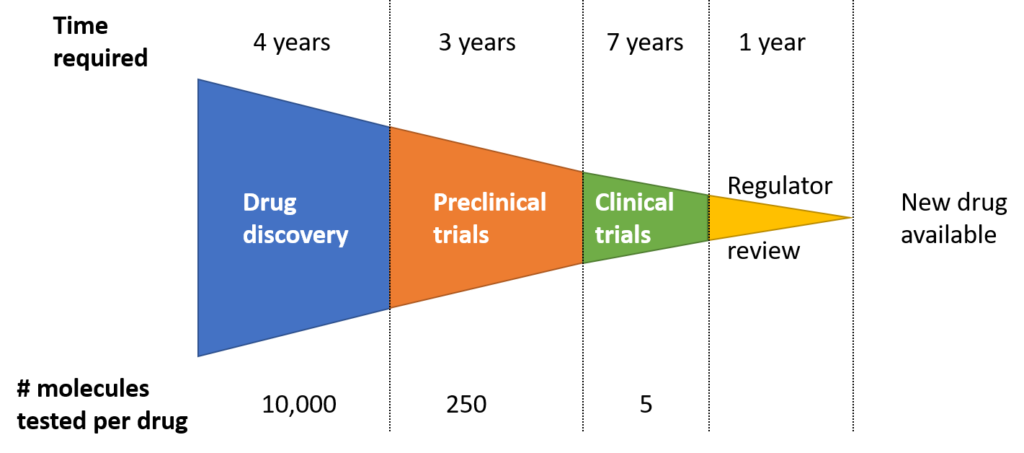
Việc tìm ra một loại thuốc điều trị mới đòi hỏi những nguồn lực to lớn, những ý tưởng khoa học xuất sắc, nỗ lực kiên trì của các nhà khoa học. Thành quả sự ra đời các loại thuốc mới là vô cùng to lớn, sẽ mang lại niềm hy vọng, cơ hội điều trị, thay đổi cuộc sống cho hàng triệu bệnh nhân.
2. Quá trình sản xuất thuốc mới như thế nào?
Quy trình sản xuất thuốc phải tuân thủ một trình tự nhất định. Theo cơ quan quản lý dược phẩm và thực phẩm Hoa Kỳ (FDA), quá trình phát triển – sản xuất thuốc gồm 5 bước cơ bản như sau:
2.1. Khám phá và phát triển thuốc
Trước khi khám phá ra thuốc, các nhà khoa học phải đi sâu vào nghiên cứu cơ chế bệnh sinh ở mức độ phân tử. Đây là cơ sở để tìm kiếm, phát triển những hợp chất có khả năng hoạt hoá/ ức chế đích tác động. Từ hàng ngàn hợp chất tiềm năng, thông thường chỉ có một vài chất đáp ứng các tiêu chuẩn để tiến hành những bước nghiên cứu xa hơn. Quá trình này tốn rất nhiều thời gian và nguồn lực. Do đó, với sự phát triển của ngành công nghiệp máy tính hiện nay, các phần mềm sàng lọc ảo in silico được thiết kế và sử dụng để sàng lọc nhanh các thư viện hợp chất khổng lồ, xác định nhanh các hợp chất có hoạt tính tiềm năng nhất trên đích tác động. Các hợp chất tiềm năng này cũng sẽ được khảo sát hoạt tính qua các thử nghiệm in vitro và in vivo để xác định hợp chất có hoạt tính trị liệu thực sự. Khi các nhà nghiên cứu đã xác định một hợp chất có triển vọng phát triển, họ sẽ tiến hành các thí nghiệm để thu thập thông tin bao gồm:
- Quá trình hấp thu, phân bố, chuyển hóa, thải trừ của chất đó
- Những lợi ích tiềm năng và cơ chế hoạt động của hoạt chất
- Liều lượng, cách dùng, các tác dụng phụ, tương tác với các thuốc khác
- Cách hoạt chất đang nghiên cứu ảnh hưởng đến các đối tượng khác nhau về giới tính, chủng tộc,… như thế nào.
- Hiệu quả của hoạt chất nghiên cứu với các loại thuốc tương tự.
Sau khi đã có sự hiểu biết về hoạt chất nghiên cứu (dược chất), xác định dạng bào chế mong muốn, giai đoạn nghiên cứu tìm ra công thức bào chế – sản xuất tối ưu nhất được thực hiện.
– Nghiên cứu tương kỵ dược chất, tá dược: Mục đích là lựa chọn tá dược dự kiến có thể dùng trong công thức. Với các dạng bào chế khác nhau thì có các phương pháp thử khác nhau nhưng nguyên lý chung là tạo sự tiếp xúc giữa hoạt chất và tá dược, để trong điều kiện lão hoá để quan sát sự thay đổi so với mẫu chứng (chỉ có dược chất). Tương kỵ xuất hiện khi khối mẫu bị biến màu, bị quá ẩm, mùi khó chịu,… so với mẫu chứng ở cùng điều kiện.
– Khảo sát các công thức – quy trình sản xuất ban đầu: Mục đích là xác định được một công thức sơ bộ gồm thành phần và khối lượng tương ứng. Việc khảo sát luôn ưu tiên theo thứ tự: Công thức ít thành phần, đơn giản nhất – Quy trình sản xuất đơn giản nhất – Tiêu chuẩn đánh giá (đánh giá những tiêu chuẩn vật lý, dễ làm trước; nếu đạt thì tiến hành những chỉ tiêu hoá học nhằm tiết kiệm thời gian và chi phí nghiên cứu).
– Tối ưu hoá công thức: Mục đích nhằm tìm ra công thức, thông số (điều kiện tiến hành) của quy trình để sản phẩm sản xuất ra đạt chất lượng theo tiêu chuẩn đã định hướng.
– Phát triển quy trình sản xuất – nâng cấp quy mô – thẩm định quy trình sản xuất: Đây là một bước quan trọng trong nghiên cứu dược phẩm (công thức và quy trình sản xuất). Phát triển quy trình sản xuất được tiến hành theo các bước: Thử nghiệm để lựa chọn phương pháp sản xuất phù hợp – Sản xuất trên quy mô thử nghiệm – Sản xuất và thẩm định quy trình ở quy mô pilot – Sản xuất và thẩm định quy trình ở quy mô sản xuất. Mục đích nhằm tạo ra sản phẩm đạt yêu cầu chất lượng và đảm bảo duy trì, đồng đều giữa các lô sản xuất thương mại.
– Xây dựng tiêu chuẩn và thẩm định tiêu chuẩn: Một bộ tiêu chuẩn chất lượng gồm: Tiêu chuẩn – Phương pháp tiến hành – Thẩm định phương pháp phân tích (protocol, report và raw data) – Phiếu kiểm nghiệm – Phần thuyết minh tiêu chuẩn.
– Phát triển bao bì đóng gói và nghiên cứu độ ổn định: Việc lựa chọn bao bì đóng gói thường sẽ dựa vào dạng bào chế cũng như tham khảo từ các sản phẩm đã sẵn có trên thị trường. Nghiên cứu độ ổn định có thể tham khảo từ các nguồn tài liệu chính thống như: ICH Q1A (R2), hướng dẫn của Asean (Asean Guideline On Stability Study Of Drug Product), Thông tư 32/2018/TT-BYT,…
2.2. Nghiên cứu tiền lâm sàng
Trước khi thử nghiệm một loại thuốc trên người, các nhà nghiên cứu phải thực hiện các nghiên cứu tiền lâm sàng nhằm xác định thuốc có khả năng gây ra độc tính hay không. Hai thử nghiệm bắt buộc thực hiện trong nghiên cứu tiền lâm sàng là: in vitro và in vivo.
In vitro là phương pháp nghiên cứu được thực hiện trên đối tượng là các phân tử sinh học, tế bào được nuôi cấy trong phòng thí nghiệm. Trong khi đó, in vivo là phương pháp nghiên cứu tác động của thuốc trên đối tượng là sinh vật sống, thông thường là động vật như chuột, thỏ…
Các nghiên cứu tiền lâm sàng sẽ cung cấp các thông tin về liều dùng, mức độ độc tính, tương tác giữa thuốc và tế bào. Dựa vào các thông tin này, các nhà nghiên cứu sẽ xem xét lại hoạt chất đang nghiên cứu có nên tiếp tục được thử nghiệm trên người hay không.
2.3. Nghiên cứu lâm sàng trên người
Nghiên cứu lâm sàng là những nghiên cứu tác động của thuốc trực tiếp trên cơ thể người. Quá trình nghiên cứu lâm sàng gồm các bước:
– Thiết kế nghiên cứu lâm sàng
– Các giai đoạn thử nghiệm lâm sàng của thuốc trước khi ra thị trường: Giai đoạn thử nghiệm lâm sàng thuốc thường tiến hành qua các giai đoạn gồm:
- Trình cơ quan quản lý cấp phép thử nghiệm lâm sàng
- Tiến hành nghiên cứu lâm sàng: Sau khi được sự cho phép từ cơ quan quản lý, nghiên cứu lâm sàng của thuốc sẽ được tiến hành và thực hiện qua 4 pha chính.
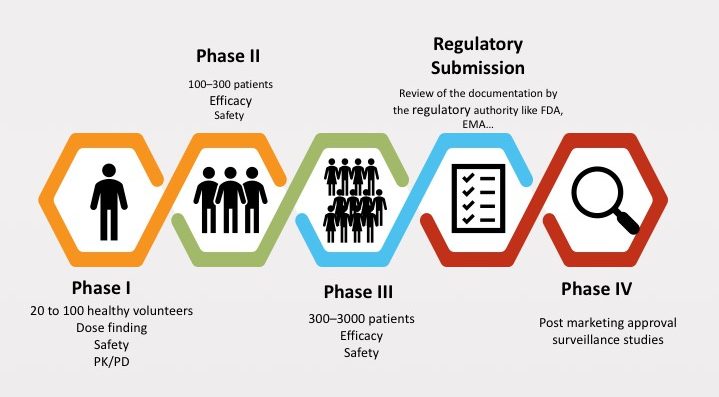
Trong suốt các giai đoạn nghiên cứu, các cơ quan quản lý sẽ tiến hành giám sát nhằm đảm bảo tính trung thực khách quan, cũng như sự an toàn cho người tham gia.
2.4. Xin cấp phép sản xuất thuốc, lưu hành thuốc từ cơ quan quản lý
Để xin cấp phép lưu hành thuốc, nhà sản xuất thuốc phải gửi bộ hồ sơ đầy đủ các dữ liệu gồm: quá trình khám phá và phát triển thuốc, các thông tin khoa học chứng minh hiệu quả và độ an toàn của thuốc qua kết quả nghiên cứu tiền lâm sàng và nghiên cứu lâm sàng, dạng bào chế, quy trình sản xuất, cách ghi nhãn thuốc…
Hội đồng chuyên gia từ cơ quan quản lý sẽ thẩm định bộ hồ sơ đăng ký để quyết định có cấp phép sản xuất thuốc, lưu hành thuốc hoặc không.
2.5. Giám sát sự an toàn của thuốc sau khi đã bán ra thị trường
Sau khi vượt qua pha 3 thử nghiệm lâm sàng, nhà sản xuất đã có thể xin cấp phép lưu hành sản phẩm, lúc này thuốc mới chỉ được sử dụng trên một số đối tượng khoảng vài nghìn người bệnh. Do đó, tính an toàn và hiệu quả thực sự của thuốc được theo dõi và xác định sau vài năm thuốc được lưu hành trên thị trường với một cơ số lớn người sử dụng. Do đó cơ quan quản lý sẽ tiếp tục theo dõi các vấn đề liên quan đến lưu hành thuốc, thu thập các báo cáo về thuốc để đưa ra những hướng dẫn kịp thời trong trường hợp thuốc xảy ra những tác dụng không mong muốn.
Tham khảo:
https://www.cern-foundation.org/education/clinical-trials/clinical-trial-phases
https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process
https://sruk.org.uk/the-drug-discovery-process/




You must be logged in to post a comment.