
Quan điểm hiện nay của các cơ quan quản lý dược phẩm trên thế giới cho rằng, Thẩm định quy trình sản xuất (TĐQTSX) là một hoạt động chứng minh tính đầy đủ và mạnh mẽ của chiến lược kiểm soát quy trình sản xuất và cung cấp sự đảm bảo liên tục rằng quy trình vẫn trong tầm kiểm soát. TĐQTSX được định nghĩa trong Hướng dẫn EMA tháng 11 năm 2016 về TĐQTSX như sau:
“Việc TĐQTSX không nên được xem như một sự kiện diễn ra một lần. TĐQTSX theo phương pháp tiếp cận dựa trên vòng đời sản phẩm sẽ liên kết giai đoạn phát triển sản phẩm và quy trình với thẩm định quy trình sản xuất cỡ lô thương mại và việc duy trì quy trình sản xuất ở trạng thái kiểm soát trong sản xuất thường quy.”
Nó cũng được định nghĩa trong Hướng dẫn TĐQTSX FDA 2011 là:
“… Việc thu thập và đánh giá dữ liệu, từ giai đoạn thiết kế quy trình đi qua sản xuất thương mại, thiết lập bằng chứng khoa học rằng quy trình có khả năng cung cấp một cách đồng nhất sản phẩm đạt chất lượng. TĐQTSX liên quan đến một loạt các hoạt động diễn ra trong vòng đời của sản phẩm và quy trình.”
So với phương pháp thẩm định truyền thống từ trước đến nay, cách tiếp cận TĐQTSX mới (nâng cao) này bao gồm ba giai đoạn, được minh họa trong Hình 1.1. Để thực hiện thẩm định dựa trên vòng đời sản phẩm, phương pháp tiếp cận dựa trên phân tích rủi ro và căn cứ khoa học được áp dụng và tích hợp kiến thức từ giai đoạn phát triển sản phẩm với hiệu suất quy trình và hệ thống giám sát chất lượng sản phẩm xuyên suốt vòng đời sản phẩm.
Hình 1.1: Tổng quan về thẩm định quy trình – Vòng đời thẩm định quy trình – Phương pháp tiếp cận nâng cao
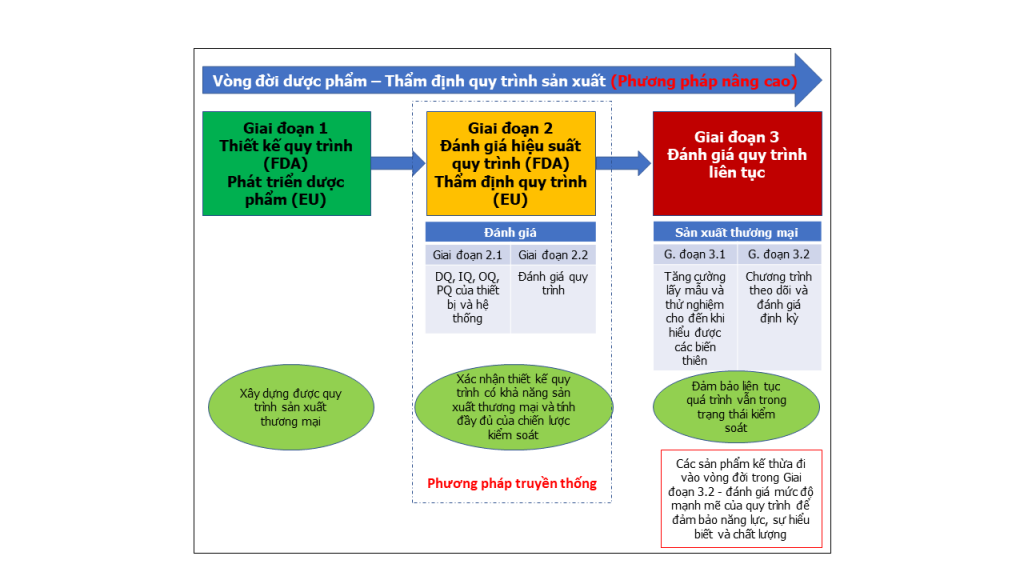
Mỗi giai đoạn của vòng đời thẩm định quy trình có sự khác biệt so với quy trình truyền thống về phát triển sản phẩm dược phẩm trước đây. Giai đoạn 1, thường được gọi là giai đoạn phát triển dược phẩm, tại gia đoạn này quy trình sản xuất thương mại được xác định. Giai đoạn 2 (thẩm định quy trình) liên quan đến việc đánh giá và xác minh thiết kế quy trình để xác định quy trình sản xuất có đủ mạnh mẽ và có tính lặp lại hay không. Giai đoạn 3, còn được gọi là đánh giá quy trình liên tục, tiếp tục đảm bảo quy trình sản xuất thường quy luôn ở trạng thái được kiểm soát.
Một chương trình thẩm định quy trình hiệu quả phải đảm bảo các thuộc tính chất lượng của sản phẩm bao gồm: chất lượng, an toàn và hiệu quả được thiết kế và tích hợp vào sản phẩm trong suốt vòng đời của nó. Điều này đạt được bằng cách đảm bảo tất cả các bước sản xuất được kiểm soát, đo lường và định lượng bằng các tiêu chuẩn chất lượng thành phẩm. Để sử dụng hiệu quả dữ liệu từ tất cả các giai đoạn, các nguyên tắc khoa học, quản lý kiến thức, tài liệu và các quy trình về chất lượng dược phẩm phải được thiết lập. Điều này thể hiện một sự thay đổi đáng kể so với hướng dẫn trước đây và các yêu cầu để chứng minh rằng một quy trình đã được thẩm định. Các nguồn biến thiên, tác động của biến thiên đối với quá trình và các thuộc tính chất lượng cần phải được hiểu rõ cũng như kiểm soát được các nguồn biến thiên đó.
Như vậy có thể nói TĐQTSX không còn là sự kiện chỉ diễn ra một lần nữa mà thay vào đó là cách tiếp cận dựa trên vòng đời sản phẩm được hầu hết các thị trường dược phẩm toàn cầu mong đợi. Thành công của TĐQTSX dựa trên việc thiết lập một quy trình sản xuất toàn diện dựa trên cơ sở khoa học, tập trung vào việc hiểu các nguồn gốc của các biến thiên để đạt được sự hiện thực hóa sản phẩm.
Tài liệu tham khảo
1. US FDA. Guidance for industry, process validation (2011): general principles and practices.
2. European Commission (EC). Guidelines on good manufacturing practice for medicinal products, Annex 15. 2015.
3. ISPE Good Practice Guide: Practical Implementation of the Lifecycle Approach to Process Validation.




You must be logged in to post a comment.