
Tổng quát
An toàn cho bệnh nhân là mục tiêu chính của Hệ thống chất lượng dược phẩm (HTCLDP), người sở hữu giấy phép sản xuất phải tạo ra các sản phẩm thuốc an toàn và hiệu quả theo những tiêu chuẩn đã đăng kí trong giấy phép lưu hành. Do đó, HTCLDP được áp dụng để đảm bảo điều này.
Nguồn lực đầy đủ (bao gồm địa điểm, thiết bị và nhân sự), chính sách chất lượng hợp lý, mục tiêu chất lượng phù hợp và các quá trình dưới dạng hướng dẫn cũng như hồ sơ đều là yếu tố quan trọng. Để đảm bảo hiệu quả của HTCLDP và môi trường có tính cải tiến liên tục, nhiều công cụ khác nhau được sử dụng, trong đó bao gồm các quy trình như: quản lý sai lệch, quản lý thay đổi, quản lý khiếu nại và quản lý biện pháp khắc phục – phòng ngừa. Ngoài ra, còn bao gồm việc thực hiện tự kiểm tra và đánh giá, soát xét sản phẩm cũng như đánh giá hệ thống quản lý. Quản lý rủi ro (QLRR) và quản lý tri thức là 2 yếu tố không kém phần quan trọng.
Trong việc lên kế hoạch, thực hiện và cải tiến liên tục HTCLDP, quản lý (cấp cao) sẽ là người đứng đầu. Việc mô tả chính sách chất lượng, cũng như xác định các mục tiêu chất lượng, phân bổ nguồn lực đầy đủ, xác định nhiệm vụ và trách nhiệm, thúc đẩy giao tiếp và thực hiện xem xét đánh giá hệ thống quản lý đều là những công việc quan trọng trong công tác quản lý. Các hướng dẫn và hồ sơ của HTCLDP được sử dụng để theo dõi và xác minh các quá trình chất lượng diễn ra có xác thực hay không trong suốt giai đoạn sản xuất dược phẩm, nhằm đảm bảo đáp ứng được các yêu cầu đã quy định.
1. Mục đích và các nguyên tắc cơ bản của HTCLDP
Mỗi bệnh nhân khi sử dụng thuốc đều hy vọng thuốc có tác dụng, loại bỏ các triệu chứng hoặc ít nhất là làm giảm các triệu chứng bệnh. Tuy nhiên, sự cố Elixir Sufanilamid năm 1937 ở Mỹ gây thiệt hại 107 mạng người và thảm kịch Thalidomid ở Đức vào những năm đầu của thập niên 60 cũng đã làm nổi bật một điều quan trọng hơn: sản phẩm thuốc phải an toàn. Đây là lý do tại sao an toàn cho bệnh nhân là mục tiêu chính của HTCLDP. Tất cả những cá nhân sở hữu giấy phép sản xuất phải chắc chắn rằng các sản phẩm thuốc được sản xuất tuân thủ theo chương 1 của hướng dẫn Thực hành sản xuất tốt của châu Âu (EU-GMP), cụ thể:
- Phù hợp với mục đích sử dụng
- Tuân thủ theo các tiêu chuẩn đã được cấp phép lưu hành hoặc cấp phép thử nghiệm lâm sàng
- Và không đặt bệnh nhân vào các trường hợp rủi ro do không đủ an toàn, chất lượng hoặc hiệu quả
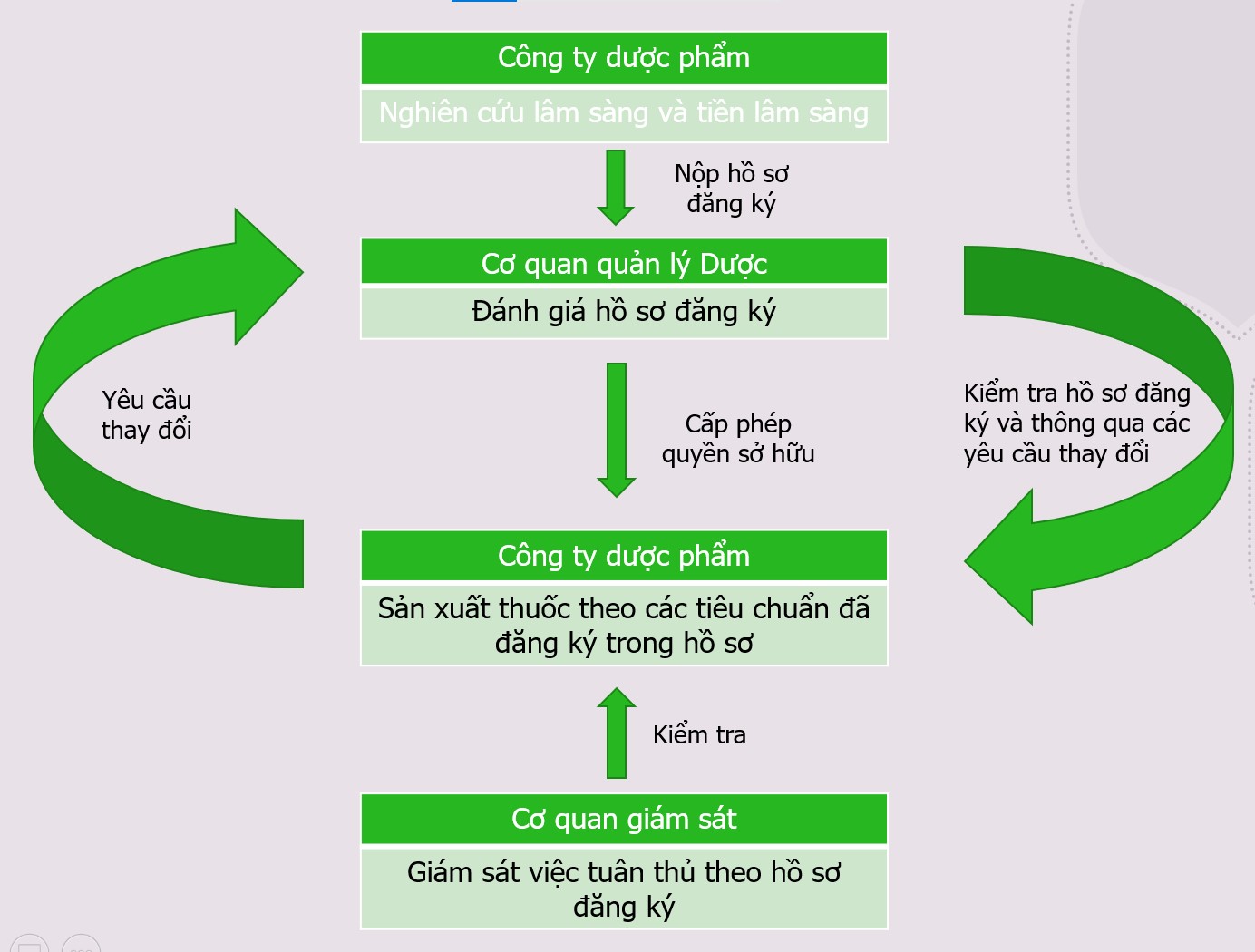
Để đạt được mục tiêu này, nhiều bên có trách nhiệm khác nhau hợp tác với các công ty dược phẩm, cơ quan quản lý và cơ quan giám sát. Trước khi nộp hồ sơ cho các cơ quan có liên quan để được cấp phép lưu hành, công ty dược phẩm phải đảm bảo rằng sản phẩm thuốc đáp ứng yêu cầu chất lượng trong suốt quá trình phát triển. Cơ quan quản lý sẽ xem xét qua hồ sơ và đưa ra quyết định thông qua hay trả lại. Nếu hồ sơ được chấp thuận, người nắm giữ giấy phép lưu hành sẽ phải thiết lập một khuôn khổ cho tất cả các công việc tiếp theo.
Theo các cơ quan chức năng, sự an toàn của bệnh nhân chỉ thực sự đảm bảo khi thuốc được sản xuất và kiểm nghiệm đúng với các tiêu chuẩn đã đăng ký trong giấy phép lưu hành. Chỉ những sản phẩm đáp ứng yêu cầu này mới được phép lưu hành trên thị trường. Nếu có bất cứ thay đổi nào đối với giấy phép lưu hành, công ty dược phẩm phải thông báo đến các cơ quan có thẩm quyền và nhận được sự chấp thuận. Bên thứ ba có liên quan là cơ quan giám sát chịu trách nhiệm kiểm tra các nhà sản xuất thuốc một cách thường xuyên để đảm bảo rằng họ đang làm theo đúng giấy phép lưu hành và GMP/GDP. Sự tương tác giữa các tổ chức này được minh họa trong Hình 1.
2. Chính sách chất lượng và mục tiêu chất lượng
Yêu cầu phải mô tả chính sách chất lượng đối với các công ty dược phẩm bắt nguồn từ ICH Q10. Chính sách chất lượng và mục tiêu chất lượng đã được bổ sung vào chương 2 (mới sửa đổi) của hướng dẫn EU-GMP vào tháng 2 năm 2014 và hiện là một phần không thể thiếu của HTCLDP.
Các yêu cầu của ICH Q10 liên quan đến chính sách chất lượng:
- Quản lý cấp cao nên thiết lập một chính sách chất lượng mô tả các ý định tổng thể cũng như các định hướng liên quan đến chất lượng của công ty.
- Chính sách chất lượng phải thể hiện kỳ vọng tuân thủ các quy định hiện hành và phải tạo môi trường cải tiến liên tục cho HTCLDP.
- Nhân viên ở tất cả các cấp cần phải được truyền đạt và hiểu rõ chính sách chất lượng của công ty.
- Cần phải xem xét lại định kỳ chính sách chất lượng để duy trì hiệu quả liên tục.
Mục tiêu chất lượng cũng được quy định trong ICH Q10 nằm ở Phần 3 của hướng dẫn EU-GMP bao gồm 3 mục tiêu chính:
- Hiện thực hóa sản phẩm: tức là HTCLDP nên cho phép việc sản xuất các sản phẩm có thuộc tính chất lượng đáp ứng được nhu cầu của bệnh nhân, chuyên gia chăm sóc sức khỏe và cả các cơ quan quản lý.
- Trạng thái kiểm soát: tức là nhà sản xuất nên thiết lập hệ thống giám sát và kiểm soát hiệu quả để đảm bảo tính phù hợp liên tục và khả năng đáp ứng của các quá trình.
- Cải tiến liên tục: bởi vì “trì trệ là thoái trào” nên các nhà sản xuất có nghĩa vụ xác định và thực hiện các cải tiến cần thiết đối với sản phẩm, quy trình và hệ thống của công ty cùng với tất cả vốn kiến thức sẵn có.
3. Công cụ của HTCLDP
Để đạt được mục tiêu chất lượng, các thành phần dưới đây của HTCLDP đóng vai trò then chốt (xem hình 2):
- Chính sách chất lượng và kế hoạch chất lượng
- Tài liệu
- Các lựa chọn công cụ
- Nguồn lực phù hợp và đầy đủ: nhà máy, cơ sở vật chất, thiết bị và nhân sự
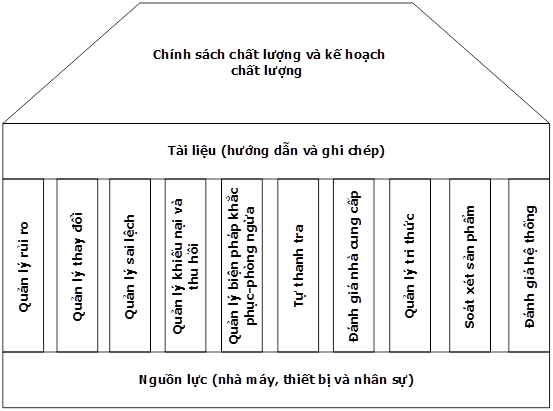
Có nhiều công cụ hiệu quả có sẵn để thực hiện, duy trì và theo dõi HTCLDP như:
- Quản lý rủi ro
- Quản lý thay đổi
- Quản lý sai lệch
- Quản lý khiếu nại và thu hồi
- Quản lý biện pháp khắc phục-phòng ngừa
- Tự thanh tra
- Đánh giá nhà cung cấp
- Quản lý tri thức
- Soát xét sản phẩm
- Đánh giá hệ thống quản lý
Quy trình cải tiến liên tục cũng là một công cụ hữu ích đối với HTCLDP. Tuy nhiên, mỗi tổ chức nên cân nhắc cẩn thận xem có nên sử dụng công cụ này hay không, vì mục tiêu của các công cụ đã nêu ra ở trên là cải tiến liên tục HTCLDP và các quá trình của nó. Chính sách chất lượng thể hiện cam kết cải tiến liên tục và các công cụ ở trên của HTCLDP cũng có thể được sử dụng để đạt được thành công này, vì vậy việc sử dụng quy trình cải tiến liên tục có thể không cần thiết.
4. Tài liệu tham khảo
- EU-GMP guideline, Part I, Chapter 1 “Pharmaceutical Quality System”
- ICH Q10 Pharmaceutical Quality System
- GMP – Verlag, Chapter 1 “Quality Management System”




