Khi các nhà sản xuất thiết bị y tế đang xem xét đưa thiết bị ra thị trường, họ phải đối mặt với thách thức trong việc hiểu môi trường pháp lý ở các khu vực pháp lý khác nhau và các yêu cầu pháp lý áp dụng cho họ và thiết bị của họ. Các cơ quan quản lý thiết bị y tế, khi họ phát triển khung pháp lý của mình trong một khu vực pháp lý cụ thể, tìm kiếm các giải pháp cho những thách thức mà họ gặp phải từ các quốc gia và khu vực khác. Các nhóm quốc gia ở các khu vực khác nhau trên thế giới đã tìm cách giảm bớt các rào cản đối với thương mại bằng cách thiết lập một thị trường duy nhất với các yêu cầu quản lý chung.
Bài viết này so sánh Quy định 1 2017/745 của Liên minh Châu Âu (EU) và Chỉ thị về Thiết bị Y tế (MDD) của Hiệp hội các Quốc gia Đông Nam Á (ASEAN). Đáng chú ý, các chỉ thị và quy định về thiết bị y tế không được đề cập trong bài viết này và nó không nhằm mục đích giải thích cho các nhà sản xuất thiết bị y tế riêng lẻ. Thay vào đó, bài viết này dựa trên phân tích được thực hiện và trình bày tại Hội nghị thường niên lần thứ 7 của Ủy ban thiết bị y tế ASEAN tại Bangkok, Thái Lan, vào tháng 12 năm 2018.
So sánh khu vực EU
Có lịch sử hình thành từ năm 1951 và ASEAN, được thành lập năm 1967, là các tổ chức tập hợp một số quốc gia với mục tiêu mang lại lợi ích cho người dân của họ. Họ chia sẻ những điểm tương đồng quan trọng và có những khác biệt chính. EU có 28 quốc gia thành viên (đang chờ Brexit) và ASEAN có 10 quốc gia thành viên. Cả EU và ASEAN đều được thành lập để thúc đẩy hòa bình và thịnh vượng trong khu vực thông qua hội nhập kinh tế và chính trị. Cả hai tổ chức đã thể hiện cam kết đối với nhân quyền: EU thông qua Hiến chương về các Quyền cơ bản và ASEAN thông qua Tuyên bố Nhân quyền. EU và ASEAN được thiết kế để hội nhập nền kinh tế của các quốc gia thành viên vào một thị trường duy nhất, từ đó thúc đẩy thương mại tự do.
Những khác biệt quan trọng trong cấu trúc và phương thức hoạt động của EU và ASEAN ảnh hưởng đến khung pháp lý đối với các thiết bị y tế ở các khu vực tương ứng. Về mặt cấu trúc, các quốc gia thành viên EU đã thừa nhận một số mức độ chủ quyền đối với EU, với sự chấp nhận lẫn nhau đối với các quyết định pháp lý, trong khi ASEAN được cấu trúc như một tổ chức tinh thần liên chính phủ. EU có một quốc hội, trong khi ASEAN có một hội đồng liên nghị viện không có thẩm quyền đối với các quốc gia thành viên. Một số quốc gia thành viên trong EU đã thông qua một loại tiền tệ chung, trong khi ASEAN duy trì các loại tiền tệ riêng biệt, nhằm khuyến khích sự phối hợp và hợp tác giữa các bộ trưởng tài chính. EU có 23 ngôn ngữ chính thức, trong khi ASEAN đã đồng ý sử dụng tiếng Anh cho các cuộc họp và thư từ.
Dân số của EU và ASEAN tương đương nhau (lần lượt là 636 triệu và 512 triệu). Tuy nhiên, quy mô của các nền kinh tế, được đo bằng tổng sản phẩm quốc nội, có sự khác biệt đáng kể, với EU là 13 nghìn tỷ USD và ASEAN là 3 nghìn tỷ USD (đô la Mỹ). Chi tiêu trung bình cho chăm sóc sức khỏe của mỗi hộ gia đình là 2.673 USD đối với EU và 107 USD đối với ASEAN (đô la Mỹ).
Sự phát triển của các quy định đối với trang thiết bị y tế
Một phân tích về các quy định đối với thiết bị y tế ở EU và ASEAN cho thấy những điểm tương đồng đáng kể cả về cấu trúc và nội dung. Đây không phải là ngẫu nhiên. Cơ quan quản lý từ các khu vực này tương tác và chia sẻ kinh nghiệm, thực tiễn tốt nhất và ý tưởng, học hỏi từ công việc của nhau. Các khu vực khác nhau cập nhật khung pháp lý của họ vào những thời điểm khác nhau và trong bối cảnh kinh nghiệm của họ cho đến thời điểm đó. Cập nhật trong một khu vực trở thành thông tin cho khu vực khác. Sự tương tác này có thể được nhìn thấy trong dòng thời gian được hiển thị trong Hình 1 và được chứng minh bằng văn bản phù hợp được tìm thấy trong nhiều phần của Quy định MDD của ASEAN và EU. Như minh họa trong Hình 1, EU đã công bố các quy định mới đối với thiết bị y tế và chẩn đoán trong ống nghiệm vào năm 2017 và đang trong quá trình chuyển sang thực hiện đầy đủ.

Hiệp hội vì sự tiến bộ của thiết bị y tế (AAMI) ủng hộ việc các cơ quan quản lý làm việc theo khu vực và toàn cầu. Công việc này đòi hỏi nhiều tài nguyên và không một quốc gia nào có thể tự mình tạo ra và duy trì cấu trúc để điều chỉnh các thiết bị trên thị trường toàn cầu ngày nay. Hơn nữa, hài hòa các tiêu chuẩn là rất quan trọng. Sự hài hòa giúp cung cấp khả năng tiếp cận thị trường cho tất cả các nhà sản xuất và tăng khả năng bệnh nhân có thể tiếp cận các thiết bị an toàn và hiệu quả.
Ba nguồn chính đã ảnh hưởng đến sự phát triển của các quy định cho các thiết bị y tế:
- Lực lượng đặc nhiệm hài hòa toàn cầu (GHTF), đã khuyến khích sự hội tụ trong các tiêu chuẩn và thực hành quy định liên quan đến an toàn, hiệu suất và chất lượng của các thiết bị y tế và đã thúc đẩy đổi mới công nghệ và thương mại quốc tế.
- Diễn đàn quản lý thiết bị y tế quốc tế (IMDRF), đã tiếp nhận sứ mệnh của GHTF vào năm 2012, cung cấp một phương tiện để thảo luận về định hướng tương lai trong việc hài hòa hóa quy định đối với thiết bị y tế.
- Nhóm Công tác Hài hòa Châu Á, nghiên cứu và đề xuất các cách để hài hòa các quy định về thiết bị y tế ở Châu Á Thái Bình Dương (bao gồm cả ASEAN) và các khu vực khác.
Chỉ thị và Quy định
Chỉ thị là các hành vi lập pháp đặt mục tiêu cho các quốc gia thành viên đạt được. Các chỉ thị không phải là những hạn chế ràng buộc và các quốc gia thành viên quyết định cách đạt được chỉ thị. Do đó, ASEAN MDD cho phép mỗi quốc gia thành viên thực hiện các điều khoản của chỉ thị một cách độc lập.
Sự hài hòa giúp cung cấp khả năng tiếp cận thị trường cho tất cả các nhà sản xuất và tăng khả năng bệnh nhân có thể tiếp cận các thiết bị an toàn và hiệu quả.
EU 2017/745 là một quy định, là một hành động ràng buộc đối với tất cả các quốc gia thành viên của liên minh. Quy định này thay thế luật quốc gia của các quốc gia thành viên.
Cả chỉ thị và quy định đều có tác động dẫn đến sự hài hòa hơn trong khu vực tương ứng. Các quy định có xu hướng đẩy nhanh quá trình hài hòa hóa này và giải quyết cả kết quả và phương pháp.
Nguyên tắc thiết yếu
Cả ASEAN và EU đều công nhận rằng các thiết bị phải đạt được hiệu suất mà nhà sản xuất mong muốn, rằng chúng phải được thiết kế theo cách phù hợp với mục đích đó và rằng chúng phải an toàn và hoạt động như mong muốn.
ASEAN đã phát triển Mẫu hồ sơ đệ trình chung, yêu cầu các nhà sản xuất, ở tất cả các khu vực pháp lý của ASEAN, chia sẻ các Nguyên tắc thiết yếu (EP) có liên quan và các phương pháp được sử dụng để chứng minh sự tuân thủ.
Quy định EU 2017/745 quy định các Yêu cầu chung về An toàn và Hiệu suất (GSPR) mà các thiết bị phải đáp ứng; chúng có thể được sử dụng làm đầu vào cho quá trình thiết kế và phát triển. Đầu ra của thiết kế và phát triển có thể được kiểm tra xác nhận và xác nhận giá trị sử dụng, khi thích hợp, dựa trên GSPRs, do đó cung cấp bằng chứng và tài liệu để chứng minh sự tuân thủ.
EP và GSPR có nhiều điểm chung; tuy nhiên, trong một số trường hợp, GSPR có thêm chi tiết hoặc tính đặc hiệu hơn so với EP.
Việc thu thập và chia sẻ bằng chứng về sự chấp nhận của thị trường hỗ trợ các cơ quan quản lý và nhà phát triển tiêu chuẩn, đồng thời nâng cao tính an toàn và hiệu quả của thiết bị.
Vai trò của tiêu chuẩn
Các tiêu chuẩn quốc tế đang xây dựng các khối cho các quy trình quản lý hài hòa để đảm bảo an toàn, chất lượng và hiệu suất của các thiết bị y tế. Các quy định cho các nhà sản xuất biết phải làm gì, trong khi các tiêu chuẩn đồng thuận cho họ biết cách thực hiện. Việc tuân thủ các tiêu chuẩn được công nhận có thể được nhà sản xuất thiết bị y tế sử dụng để chứng minh việc tuân thủ các EP/GSPR có liên quan của thiết bị y tế. Cả Quy định 2017/745 của EU và MDD của ASEAN đều quy định vai trò của các tiêu chuẩn như một phương tiện tự nguyện để nhà sản xuất có thể chứng minh sự phù hợp với các yêu cầu quy định. Tại EU, nếu nhà sản xuất không sử dụng các tiêu chuẩn hài hòa, thì họ phải chứng minh điều này về mặt kỹ thuật, khoa học và lâm sàng với cơ quan được thông báo.
AAMI ưu tiên các giải pháp toàn cầu, áp dụng triết lý “Một tiêu chuẩn, một thử nghiệm trên toàn thế giới”. Hiệp hội nhấn mạnh tính cởi mở, minh bạch và đúng thủ tục, với sự đại diện của tất cả các bên liên quan trong quá trình phát triển tiêu chuẩn. Trừ khi các điều kiện quốc gia cụ thể đòi hỏi các tiêu chuẩn an toàn quốc gia khác nhau, chúng nên tránh. AAMI thúc đẩy sự an toàn và hiệu quả của công nghệ y tế, cũng như khả năng tiếp cận của các nhà cung cấp dịch vụ chăm sóc và bệnh nhân. Các tiêu chuẩn thúc đẩy sự chấp nhận theo quy định, lâm sàng và bệnh nhân đối với các công nghệ mới và giảm các rào cản kỹ thuật đối với thương mại.
Các tiêu chuẩn hỗ trợ quy định trong suốt vòng đời của thiết bị y tế là rất quan trọng. Việc thu thập và chia sẻ bằng chứng về sự chấp nhận của thị trường hỗ trợ các cơ quan quản lý và nhà phát triển tiêu chuẩn, đồng thời nâng cao tính an toàn và hiệu quả của thiết bị.
Cơ quan có thẩm quyền
ASEAN và EU yêu cầu các quốc gia/quốc gia thành viên lần lượt lựa chọn và xác định Cơ quan có thẩm quyền về thông tin pháp lý và Cơ quan có thẩm quyền đối với các thiết bị y tế (CAMD) (Bảng 1). Cơ quan này thường là Bộ Y tế của từng quốc gia thành viên hoặc một cơ quan có liên quan đến Bộ Y tế. Tại EU, Ủy ban châu Âu chịu trách nhiệm thực hiện đúng các quy định và điều phối hoạt động của các quốc gia thành viên.
Bảng 1. Các quốc gia/quốc gia thành viên: Cơ quan thông tin pháp lý của Hiệp hội các quốc gia Đông Nam Á (ASEAN) và Cơ quan có thẩm quyền về thiết bị y tế của Liên minh châu Âu (EU).

Các bên liên quan
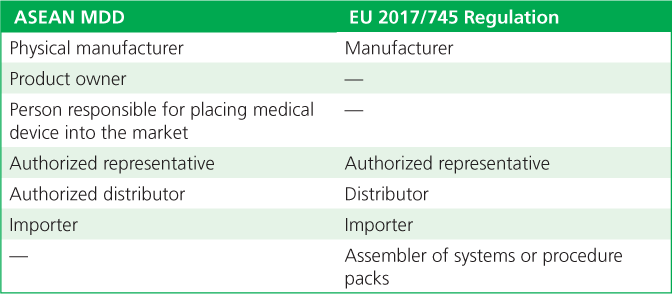
ASEAN và EU công nhận các bên tương tự trong chuỗi cung ứng thiết bị y tế. Cả hai thực thể đều nhận ra tầm quan trọng của các tổ chức tham gia vào vòng đời của một thiết bị bắt đầu từ thiết kế của thiết bị và chuyển qua sản xuất, phân phối tới người dùng cũng như giám sát về an toàn và hiệu suất. Mặc dù sử dụng thuật ngữ hơi khác nhau, nhưng cả ASEAN và EU đều công nhận vai trò và trách nhiệm then chốt của tổ chức có tên trên sản phẩm. Tổ chức này có trách nhiệm tổng thể đối với vòng đời của sản phẩm, cho dù nó tự thực hiện các hoạt động hay nhờ các tổ chức khác đảm nhận một số hoặc tất cả các hoạt động thay mặt nó (Bảng 2).
Bảng 2. Thuật ngữ được sử dụng cho các bên trong chuỗi cung ứng trong Chỉ thị về Thiết bị Y tế (MDD) của Hiệp hội các Quốc gia Đông Nam Á (ASEAN) và Quy định 2017/745 của Liên minh Châu Âu (EU)
Định nghĩa trang thiết bị y tế
Quy định MDD của ASEAN và Quy định 2017/745 của EU xác định các thiết bị y tế tương tự nhau, cả hai đều được rút ra từ các phiên bản trước đây của các chỉ thị của EU và tài liệu GHTF. Các tiêu chuẩn của Tổ chức Tiêu chuẩn hóa Quốc tế và AAMI cũng sử dụng các nguồn tương tự để xác định các thiết bị y tế. Các định nghĩa nắm bắt được các mục đích chẩn đoán, phòng ngừa, theo dõi, điều trị và giảm bớt bệnh tật hoặc bồi thường cho một thương tích; điều tra, thay thế hoặc sửa đổi các quá trình giải phẫu hoặc sinh lý; hoặc kiểm soát sự thụ thai.
Định nghĩa Quy định 2017/745 của EU lần đầu tiên bao gồm thiết bị khử trùng thiết bị y tế dưới dạng thiết bị theo quyền riêng của chúng. Trước đó, các thiết bị khử trùng nằm ngoài định nghĩa về thiết bị y tế. Với thay đổi này, thiết bị khử trùng thuộc danh mục thiết bị y tế thay vì phụ kiện theo Quy định về thiết bị y tế của EU.
Các mặt hàng và thiết bị có tính năng đặc trưng của thiết bị y tế nhưng không có mục đích y tế cụ thể, chỉ có mục đích thẩm mỹ (ví dụ: thiết bị hút mỡ, kính áp tròng không cần toa), được liệt kê trong một phụ lục trong Quy định 2017/745 của EU và được quy định như nếu chúng là thiết bị y tế.
Tài liệu tham khảo
Brad Schoener; Eamonn Hoxey
Biomed Instrum Technol (2019) 53 (3): 208–213.
https://doi.org/10.2345/0899-8205-53.3.208